In der heutigen medizinischen Landschaft gewinnt die personalisierte Onkologie zunehmend an Bedeutung, da sie darauf abzielt, individuelle Behandlungsansätze für Krebspatienten zu entwickeln. Durch den Einsatz innovativer Technologien wie Photon-Counting-CT und Radiomics wird es möglich, präzisere Diagnosen zu stellen und die Tumorbiologie besser zu verstehen. Künstliche Intelligenz (KI) spielt dabei eine entscheidende Rolle, indem sie große Datenmengen analysiert und Muster erkennt, die für die Therapieentscheidung von Bedeutung sind. Herr Prof. Dr. med. Stefan Schönberg, Direktor der Klinik für Radiologie und Nuklearmedizin der Universitätsmedizin Mannheim im Gespräch mit Herrn Prof. Dr. med. Matthias Frölich, Leiter des Geschäftsfeldes Onkologische Diagnostik und personalisierte CT-Bildgebung und Oberarzt der Klinik für Radiologie und Nuklearmedizin der Universitätsmedizin Mannheim.
(S): Welche fachlichen Herausforderungen und Möglichkeiten bringt die personalisierte Onkologie in der Radiologie mit sich?
(F) In der onkologischen Therapie ist die Personalisierung durch genetisch angepasste Behandlungsstrategien und entsprechende Therapieprotokolle bereits alltäglich. In der Diagnostik haben wir zwar große Fortschritte in der Genauigkeit der Methoden erzielt, jedoch besteht noch Potenzial für eine stärkere Personalisierung. Die Herausforderung besteht darin, diagnostische Prozesse ähnlich individuell zu gestalten wie die Therapie. Dies erfordert eine engere interdisziplinäre Zusammenarbeit sowie den Einsatz innovativer Technologien wie die Photon-Counting-Computertomografie, um diagnostische Verfahren an die spezifischen Bedürfnisse der Patienten anzupassen und gezieltere Behandlungsentscheidungen zu ermöglichen.
Welche Revolution stellt das Photon-Counting-CT in technischer und klinischer Hinsicht dar?
Das Photon-Counting-CT setzt einen neuen Maßstab in der Computertomografie, da es im Gegensatz zu herkömmlichen Detektoren einzelne Röntgenphotonen direkt erfasst und nach ihrer Energie unterscheidet. Im Vergleich zu konventionellen CTs, die Röntgenstrahlung nur indirekt messen, bietet das Photon-Counting-CT eine bisher nicht erreichte Auflösung von bis zu 0,2 mm Schichtdicke und einen inhärenten spektralen Kontrast. Besonders in der onkologischen Diagnostik bietet diese Technologie enorme Vorteile, da sie eine präzisere Läsionscharakterisierung und eine optimierte Kontrastmittelvisualisierung ermöglicht.
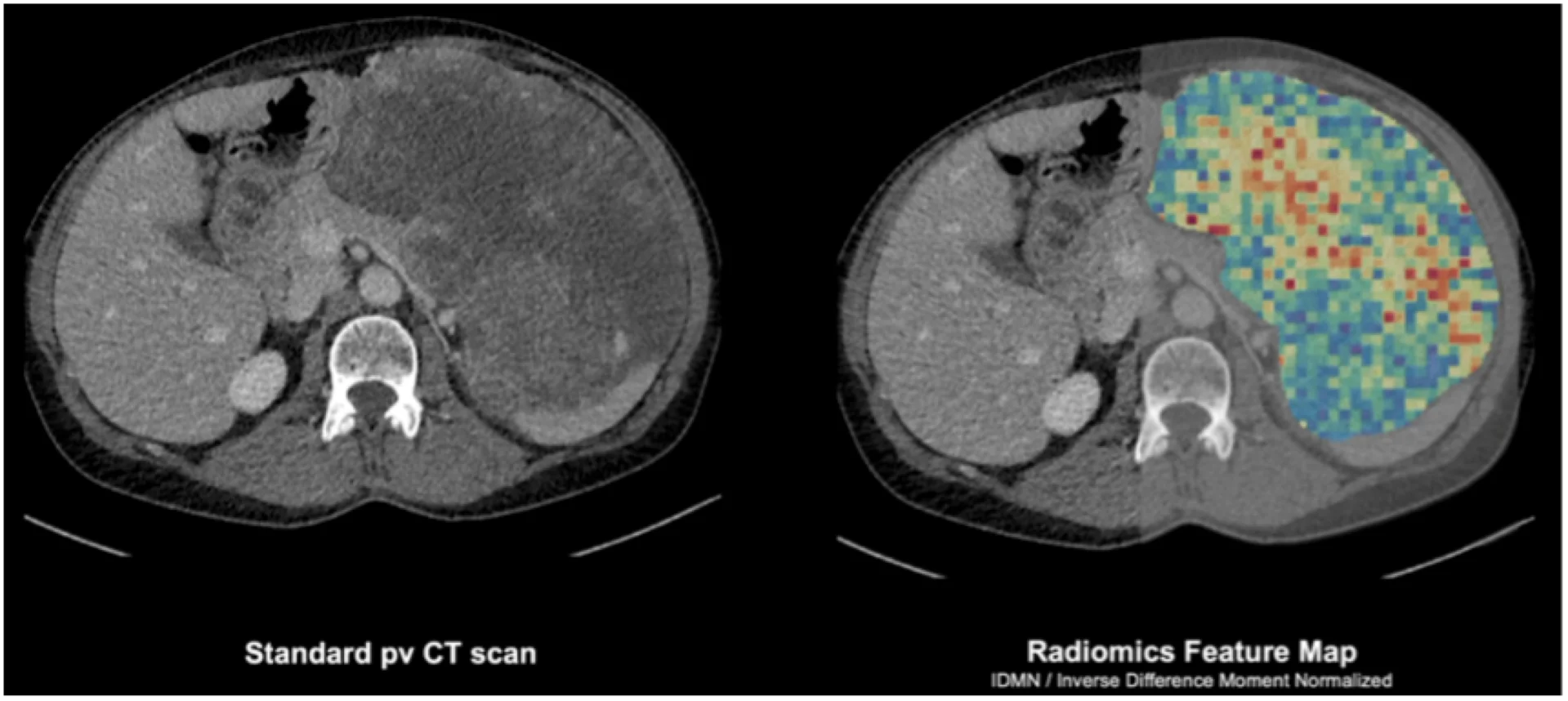
Mit der Analyse der Signalverteilung der Pixel durch Radiomics kann der hohe Kontrast des Photon-Counting-CTs optimal genutzt werden. Welche Chancen bietet Radiomics und wie unterscheidet es sich von bisherigen Bildinformationen, insbesondere am Photon-Counting-CT?
Radiomics ermöglicht die Extraktion quantitativer Bildmerkmale, die über das hinausgehen, was das menschliche Auge wahrnehmen kann. Diese Merkmale umfassen Textur-, Dichte- und Formanalysen, die für eine präzisere Klassifikation von Tumoren genutzt werden. In Kombination mit künstlicher Intelligenz (KI) lassen sich so subtile Muster erkennen, die eine präzisere Diagnosestellung und Therapieplanung ermöglichen.
Gerade in der onkologischen Bildgebung ist die Heterogenität von Tumorerkrankungen für die Biopsieplanung und die Therapie eine große Herausforderung. Die Informationen, die man mittels künstlicher Intelligenz und Radiomics aus den Bilddaten gewinnen kann, ermöglichen uns nun erstmalig, die sogenannte tumorale Heterogenität im Bild darzustellen und so neuartige vielversprechende Therapiekonzepte für unsere Patientinnen und Patienten zu entwickeln. Hier hilft uns auch das bessere Signal beim Photon-Counting-CT. Die quantitativen Features haben eine gewisse Anfälligkeit für das Bildrauschen. Im Photon-Counting-CT messen die Detektoren einzelne Photonen und reduzieren so das Bildrauschen dramatisch. Das elektronische Rauschen kann durch das Messen von einzelnen Photonensignalen abgetrennt und aus dem gesamten Datensatz entfernt werden. Somit hat man zum einen eine bessere Dosiseffizienz und eine bessere Bildqualität, zum anderen eine viel höhere Stabilität. Zudem ermöglicht der spektrale Kontrast die Anwendung von virtuell monoenergetischen Rekonstruktionen, wodurch die Vergleichbarkeit von Bilddaten – etwa für Forschungszwecke oder das KI-Training – optimiert wird.
Wie wird künstliche Intelligenz bei der Herausarbeitung der Radiomics-Features genutzt? Welche Rolle spielen neuronale Netze oder Technologien zur Segmentierung von Läsionen?
Es werden KI-Methoden entlang des gesamten Forschungsprozesses eingesetzt. Dazu gehören neuartige Large Language-Models zur Informationsextraktion aus Texten und zur Informationsstrukturierung genau wie KI-Algorithmen zur automatischen Segmentierung von Organen und malignen Läsionen sowie zur Klassifikation von Bildbefunden. Durch den Einsatz von KI bzw. das Training von Convolutional Neural Networks und neuartigen KI-Architekturen wie Vision Transformer kann beispielsweise eine Klassifikation in gutartige und bösartige Läsionen vorgenommen werden.
Convolutional Neural Networks (CNNs): CNNs sind spezielle neuronale Netzwerke, die für die Bildverarbeitung optimiert wurden. Sie werden in der Radiologie genutzt, um Läsionen automatisch zu erkennen, Bilder zu klassifizieren und diagnostische Entscheidungen zu unterstützen.
Zusammen mit der Klinischen Chemie wurde das Zentrum für integrative Diagnostik (CID, Center of Integrative Diagnostics) aufgebaut. Was bedeutet integrative Diagnostik genau?
Integrative Diagnostik ist ein neuer Ansatz, bei dem verschiedene diagnostische Disziplinen intelligent miteinander vernetzt werden, um die bestmögliche Diagnosestrategie für Patienten zu entwickeln. Statt starre, parallele Diagnostikpfade zu verfolgen, wird eine interdisziplinäre Zusammenarbeit gefördert, etwa durch gemeinsame diagnostische Boards. Ein Beispiel ist die Kombination von hochmoderner Labormedizin (wie Liquid Profiling) mit modernster Bildgebung (wie Ultra High Resolution Photon-Counting-CT oder PET-MRT). Diese Methodenkombination ermöglicht es, Tumorrezidive frühzeitig zu erkennen und gezielte Therapiestrategien zu entwickeln.
Die personalisierte onkologische Diagnostik, insbesondere integrative onkologische Diagnostik, erfordert große Datenmengen. Wie vernetzt ihr euch in Baden-Württemberg, um die integrative Diagnostik zu fördern?
In Baden-Württemberg haben wir eine enge Kooperation zwischen den Universitätskliniken etabliert. Ausgangspunkt ist das Photon-Counting-Konsortium Baden-Württemberg (PC3), über das wir an drei Standorten weltweit mit die ersten Photon-Counting-CTs installieren konnten. Das Folgeprojekt AIDA bietet über eine vernetzte Infrastruktur mittels Teamplay Digital Health-Plattformen den datenschutzkonformen Austausch von Gesundheitsdaten für klinische Anwendungen und Forschung. Begonnen haben wir mit drei Universitätskliniken und konnten bald weitere universitäre und nicht universitäre Zentren einbinden.
Welche Opportunitäten für öffentliche private Partnerschaften und Start-ups im Bereich der KI- und Softwareentwicklung ergeben sich dadurch?
Das AIDA-Projekt schließt direkt an den Standorten etablierte Forschungskooperationen, wie beispielsweise den Forschungscampus M2OLIE am Standort Mannheim an und bietet diesen Zugang zu der erwähnten digitalen Infrastruktur für Start-up-Unternehmen im Land Baden-Württemberg, sodass diese die Daten beispielsweise für KI-Trainings oder für die Entwicklung neuartiger Produkte nutzen können. Durch die enge Verzahnung von Forschung, Klinik und Industrie entstehen neue Möglichkeiten für Start-ups und private Unternehmen. Ein weiteres Beispiel ist das INSPIRE Living Lab, das an der Universitätsmedizin Mannheim Start-ups sowie kleinen und mittelständischen Unternehmen die Möglichkeit bietet, neu entwickelte digitale Gesundheitsprodukte direkt im klinischen Alltag zu testen und weiterzuentwickeln. Auf einer speziell eingerichteten Station werden Patienten der Klinik für Urologie und Urochirurgie sowie des Orthopädisch-Unfallchirurgischen Zentrums behandelt, wobei innovative Technologien zum Einsatz kommen.